You are here
Como representar graficamente uma pandemia

As doenças têm atingido os humanos desde que existem – pensa-se que a malária e a tuberculose provocaram danos grave no Antigo Egipto há mais de 5000 anos. De 541 a 542 d.C estima-se que uma pandemia global, conhecida como “a Praga de Justiniano”, matou entre 15-25% da população mundial de 200 milhões. Após a conquista do México pelo Espanha, a população nativa decresceu de 30 milhões em 1519 para apenas 3 milhões 50 anos depois. Hoje estamos a lutar para controlar o virus COVID-19 que tem potencial para causar a pandemia mais mortal da história da humanidade.
Existe, contudo, um campo da ciência pouco conhecido mas com muito sucesso a trabalhar nos bastidores para desvendar os mistérios da doença infecciosa. Como eu exploro em A Matemática da Vida e da Morte, a epidemologia matemática está a desempenhar um papel fundamental no combate às doenças infecciosas de grande escala como o COVID-19.
Com modelos matemáticos básicos, os investigadores podem começar a prever a progressão de doenças e a compreender o efeito das intervenções na propagação da doença. Com modelos mais complexos, podemos começar a responder a questões sobre como alocar recursos limitados ou retirar conclusões de intervenções de saúde pública, como fechar bares e proibir reuniões.
As informações provenientes dos modelos matemáticos são vitais para assegurar que as autoridades possam evitar o maior número possível de mortes. À medida que a pandemia COVID-19 se intensifica, fica aqui uma perspetiva dos modelos que os especialistas usam para tentar manter-se um passo à frente do vírus.
O modelo S-I-R
Um dos modelos matemáticos mais simples da propagação da doença divide a população em três categorias básicas de acordo com o estado da doença. As pessoas que ainda não tiveram a doença são rotuladas como “suscetíveis”. É assumido que todas as pessoas nascem suscetíveis e passíveis de ser infetadas. Aquelas que contraíram a doença e podem transmiti-la aos suscetíveis são os “infecciosos”. As pessoas do terceiro grupo são eufemisticamente referenciadas como a classe “removida”. Estas são as pessoas que já tiveram a doença e recuperaram e passam a ser imunes ou aquelas que morreram. Estes indivíduos “removidos” já não contribuem para a propagação da doença.
Este é conhecido como o modelo S-I-R. Da febre do dengue na América Latina à febre suína nos Países Baixos e ao norovirus na Bélgica, o modelo S-I-R pode fornecer lições vitais sobre como prevenir a propagação de doenças.
Este modelo ilustra a importância do isolamento social de quem está infetado. Ao permanecer em casa até à recuperação total, a pessoa retira-se efetivamente da classe de infetadas diretamente para a classe dos removidos sem contrair o vírus. Este simples ato pode reduzir o tamanho de um surto ao diminuir as oportunidades para a doença passar para indivíduos suscetíveis.
Quer um surto se propaga ou morre é em grande parte ditado por um único número que é exclusivo para aquele surto – o número de reprodução básico.
Se pensarmos numa população que é completamente suscetível a uma doença particular – tal como a população global em dezembro de 2019, no início do surto de COVID-19. A média de indivíduos previamente não expostos, infetados por apenas um portador da doença recentemente introduzido, é chamado o número de reprodução básico, e frequentemente denotado como R0 (pronuncia-se “R-nought” ou “R-zero”).
Se uma doença tem um R0 menor que um, então a infeção irá morrer rapidamente na medida em que uma pessoa infecciosa passa a doença, em média, a menos de um outro indivíduo. O surto não consegue sustentar a sua própria reprodução. Se o R0 for maior que um então o surto irá crescer exponencialmente.
Explosão exponencial
As estimativas iniciais colocam o número de reprodução básico para o COVID-19 entre 1.5 e 4, com um valor de pelo menos 2 em dezembro e janeiro. Com um número de reprodução básico de 2, a primeira pessoa com a doença propaga-a a duas outras, as quais, em média, propagam a doença a outras duas e depois cada uma a outras duas e assim em diante.
Este crescimento exponencial é caraterístico da fase inicial da infeção. Se fosse permitido que a propagação continuasse assim, dez gerações abaixo da cadeia de progressão, mais de 1.000 pessoas seriam infetadas. Dez passos em frente, e o total elevar-se-ia a mais de um milhão.

Evolução do total de casos de pessoas infetadas pelo Covid-19 no Reino Unido
Na prática, o crescimento exponencial previsto pelo número de reprodução básico é raramente sustentável após algumas gerações. Os surtos eventualmente atingem um pico e depois começam a diminuir devido ao decréscimo dos contactos entre infecciosos e suscetíveis.
Mesmo quando já não existem infecciosos e o surto está oficialmente terminado, alguns suscetíveis vão permanecer. O modelo S-I-R pode fornecer uma estimativa do tamanho final da epidemia – o número de pessoas infetadas no fim do surto se não forem tomadas medidas para remediar a situação. No ponto mais baixo das estimativas para o COVID-19, um número de reprodução de 1.5, significa que 58% da população mundial seria infetada. No ponto mais alto da estimativa, com um R0 de 4, o modelo S-I-R prevê que apenas 2% da população não seria infetada se não fossem tomadas quaisquer medidas.
Um número crucial
O número de reprodução básico ajuda a perceber quase todos os surtos porque engloba todas as subtilezas da transmissão da doença num único número. Desde a maneira como a doença se desenvolve no corpo, ao modo de transmissão – e até as estruturas das sociedades em que se propaga – ele capta todas as caraterísticas principais do surto e permite-nos reagir em conformidade.
Tradicionalmente o R0 pode ser dividido em três componentes: o tamanho da população, a taxa a que os suscetíveis se tornam infetados (muitas vezes referida como a força da infeção) e a taxa de recuperação ou morte pela doença. Quanto maior é a população e quão mais rápida é a propagação da doença entre os indivíduos, maior será o surto. Quão mais rápido os indivíduos recuperem, menos tempo estarão infecciosos e, consequentemente, será mais fácil controlar um surto.
Depois temos o número de reprodução efetivo. Este é o número médio de infeções secundárias causadas por um indivíduo infeccioso num dado ponto na progressão do surto. Se, através da intervenção, o número de reprodução efetivo poder ser reduzido a menos de um, então a doença irá terminar.
Taxa de letalidade
Apesar de crucial para o controlo da doença, o R0 não nos diz o quão grave a doença é para um indivíduo infetado. A proporção de pessoas que em última instância morrem de uma doença é conhecida como a taxa de letalidade.
Uma doença altamente infecciosa tal como o sarampo, com um R0 entre 12 e 18, tem uma taxa de letalidade relativamente baixa comparada com os 50-70% dos pacientes com Ébola que eventualmente morrem da doença. Consequentemente, o sarampo é tipicamente considerado menos grave que o Ébola apesar do Ébola ter um R0 muito mais pequeno, de cerca de 1.5. As estimativas iniciais indicam que a taxa de letalidade dos casos de COVID-19 é entre 0.25% e 3.5%.
É importante lembrar que a taxa de letalidade dos casos não é fixa – ela depende das respostas da sociedade e dos indivíduos à doença, assim com da demografia da população que é infetada. Por exemplo, a taxa de letalidade dos casos de COVID-19 parece variar significativamente com a idade do paciente, sendo as pessoas mais velhas as mais afetadas.
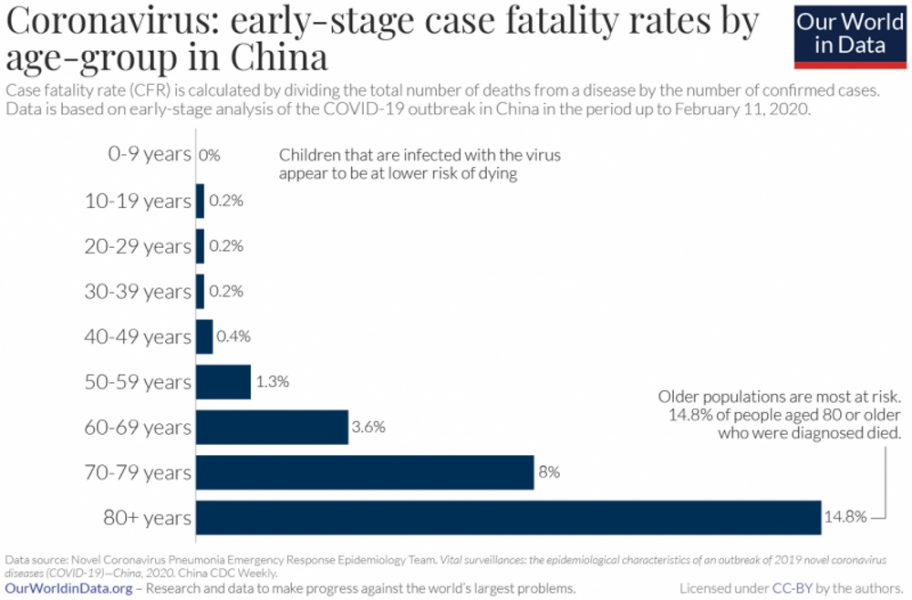
Covid-19 na China: gráfico da taxa de letalidade por agrupamento de idade
Talvez de maneira surpreendente, as doenças com maior taxa de letalidade tendem a ser menos infecciosas. Se uma doença mata demasiadas das suas vítimas demasiado rápido então acaba por reduzir as hipóteses de contágio. As doenças que matam a maioria das pessoas que infetam e que também se propagam eficientemente são muito raras e são habitualmente confinadas a filmes de desastres.
Apesar de uma alta taxa de letalidade aumentar o medo significativamente durante um surto, doenças com um elevado R0 mas com uma taxa de letalidade mais baixa (pensemos no COVID-19 em comparação com o Ébola) pode acabar por matar mais pessoas em virtude da sua capacidade de infetar um número maior de pessoas.
Controlar um surto
Uma das maneiras mais eficazes de reduzir a propagação de uma doença é a vacinação. Ao fazer as pessoas passar diretamente de suscetíveis para removidas, ultrapassando o estado de infecciosas, reduz efetivamente o tamanho da população suscetível.
Contudo, a vacinação é tipicamente uma medida de precaução que é usada para reduzir a probabilidade de ocorrer um surto. Uma vez em curso um surto, como a atual pandemia COVID-19 que está em pleno desenvolvimento, é muitas vezes impossível desenvolver e testar uma vacina em tempo útil.
A quarentena e o isolamento podem efetivamente reduzir a taxa de transmissão e, consequentemente, o número de reprodução efetivo. Isolar os pacientes infetados reduz a taxa de propagação, ao passo que a quarentena de indivíduos saudáveis reduz a população suscetível efetiva.
Ambas as ações contribuem para a diminuição do número de reprodução efetivo que é a razão pela qual o distanciamento social e o auto-isolamento são estratégias importantes para combater o COVID-19.

Desinfeção de ruas do Barreiro, 24 de março de 2020 – Foto de Rui Minderico/Lusa
Imunidade de rebanho
Uma ideia que o governo do Reino Unido considerou nos primeiros dias da sua resposta foi a da imunidade de rebanho – o conceito de que uma grande parte da população de indivíduos imunes pode desacelerar ou até travar o avanço das doenças. Surpreendentemente, este efeito comunitário não requer que toda a gente seja imune à doença para que toda a população esteja protegida. Ao reduzir o número de reprodução efetivo para menos de um – assegurando que as pessoas infetadas contactam o menos possível com pessoas suscetíveis – as cadeias de transmissão podem ser quebradas e o caminho de progressão da doença interrompido. Crucialmente, a imunidade de rebanho significa que a população que está imunocomprometida, as pessoas mais velhas, as mulheres grávidas e outros grupos de alto risco podem beneficiar da proteção assegurada pela imunidade de outras pessoas.
A fração da população que precisa de ser imune para proteger a restante varia, dependendo do quão contagiosa é a doença. O número de reprodução básico, R0, determina qual a proporção. Quanto mais alto é o número de reprodução básico, mais alta tem de ser a proporção da população imune. Por exemplo, para uma doença com um número de reprodução básico de 4, o modelo S-I-R calcula que três quartos da população têm de ser imunes. Se o R0 for baixo até 1.5 então potencialmente apenas um terço da população tem de adquirir imunidade para proteger os restantes dois terços.
Se estiver disponível uma vacina, então a imunidade de rebanho pode ser alcançada através da vacinação de uma proporção da população suficientemente elevada (dito isto, apenas conseguimos eliminar completamente uma doença humana – a varicela – através da vacinação).
Quando uma vacina não está disponível, a única maneira de as pessoas adquirirem imunidade é ficarem infetadas com a doença e recuperarem. Dada a taxa de letalidade do COVID-19, isto iria significar a morte de milhares de pessoas. Sem surpresa, o governo do Reino Unido recuou na sua ideia de política pública inicial.
A próxima geração de modelos de previsão
Na realidade, o simples modelo S-I-R não é suficientemente complexo para capturar as subtilezas de muitos surtos de doenças infecciosas. Mas para doenças que conferem imunidade às suas vítimas, uma simples adaptação do modelo S-I-R pode ajudar.
Como é típico de algumas doenças sexualmente transmitidas, a gonorreia não tem qualquer população removida. Uma vez tratados da gonorreia, os pacientes podem ser infetados de novo. Uma vez que ninguém morre dos sintomas de gonorreia, ninguém é “removido” da população. Tais modelos são rotulado de S-I-S, imitando a progressão do padrão de um indivíduo de suscetível para infetado e de volta a suscetível. Uma vez que a população de pessoas suscetíveis nunca se esgota, mas renova-se à medida que as pessoas recuperam, o modelo S-I-S indica que as doenças podem tornar-se autosustentadas ou “endémicas”.
Que uma única infeção com o COVID-19 tenha sido suficiente para a dotar de imunidade era umas das grandes preocupações dos cientistas no início do surto da COVID-19. Poderia o novo vírus circular indefinidamente na população? Apesar de terem existido vários relatos de pessoas a serem infetadas pelo vírus uma segunda vez, também há evidências que sugerem que pacientes que recuperaram do COVID-19 se tornaram imunes.
Outro problema com o novo coronavírus é que tipicamente existe um período assintomático no início da doença. Durante esse tempo, as pessoas podem ter o vírus e infetar outras pessoas sem que elas próprias apresentem sintomas. Isso significa que precisamos de adicionar outra classe de pessoas ao modelo.
Estas são pessoas que, uma vez infetadas, são capazes de transmitir a doença enquanto aparentam não ter sintomas – a chamada classe dos “transmissores”. Isto transforma o modelo S-I-R num modelo S-C-I-R. A classe dos transmissores é vital para representar doenças como o HIV/SIDA, que tem longos períodos de infeção sem sintomas óbvios.
Os modelos de última geração que estão a ser usados nos dias de hoje para informar as políticas públicas são ainda mais complicados. E, infelizmente, até os modelos matemáticos mais detalhados e realistas não são capazes de prever quando será travada a atual pandemia.
Mas é certo que, quando tomarmos o controlo da situação, os matemáticos e os seus modelos terão desempenhado um papel significativo na maneira como o drama se desenrolou.
Artigo de Christian Yates, professor de Biologia Matemática na Universidade de Bath, publicado em The Conversation.











Add new comment